脱酰胺作用 - 蛋白质和多肽反相HPLC分析和纯化指南
蛋白质在高温或高pH值下会降解。
在胁迫条件下,最有可能发生的化学降解是酰胺侧链上的天冬酰胺转变为天冬氨酸或异天冬氨酸(图37)。
天冬酰胺脱去酰氨基时,许多蛋白都会失去生物活性,但也有部分蛋白的生物活性不受影响。
即使脱酰胺作用不造成生物活性的减弱,脱酰胺作用也是蛋白接触不利条件的指示。
特定天冬酰胺残基脱酰胺的可能性取决于其在蛋白质三级结构中的位置。
只有那些与溶剂接触表面接近的天冬酰胺残基才会发生脱酰胺作用。
相邻的氨基酸残基同样影响脱酰胺作用的可能性。与天冬酰胺相邻的甘氨酸极大地增加了脱酰胺作用的可能性。
与天冬酰胺相邻的亮氨酸和异亮氨酸等大分子疏水性氨基酸降低了脱酰胺作用的可能性。
由于脱酰胺作用会影响生物活性并能指示不利条件,因此惯常的做法是监测蛋白质治疗药物中天冬酰胺的脱酰胺作用。
图37. 当酰胺侧链暴露在高温和/或高pH条件下时,天冬酰胺转化为天冬氨酸。
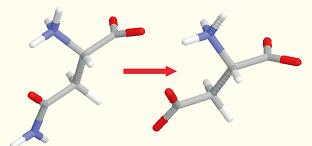
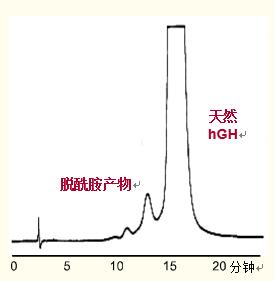
图38. 人生长激素脱酰胺作用的反相色谱分析
条件
色谱柱:C4 宽孔柱, 4.6 x 250 毫米
流动相:29% 异丙醇,71% 10 mM Tris盐酸缓冲液、pH=7.5
这通常由反相高效液相色谱法实现。
图38显示了通过完整蛋白分子的反相色谱法测量人生长激素的脱酰胺作用的一个试验。
该试验pH为7.5,以使脱酰胺作用产生的天冬氨酸电离。
这使得脱酰胺的生长激素相较于天然蛋白疏水性减弱,从而比天然蛋白先洗脱出来。
更常见的一种方法是通过肽图中含天冬酰胺/天冬氨酸多肽的保留时间来测定脱酰胺作用。
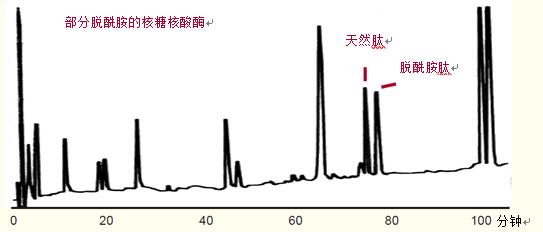
在pH为2的肽图中,含有天冬氨酸的脱酰胺肽的疏水性比含天冬酰胺的天然肽略强,因此比天然肽略晚洗脱出来,如图39所示。
脱酰胺肽容易鉴别测定,为脱酰胺作用的判定提供了较好的方法。
图39. 部分脱酰胺的核糖核酸酶的肽图
条件
色谱柱:C18 宽孔柱, 4.6 x 250 毫米
流动相:5%~38% 乙腈—0.1% TFA体系,混合梯度洗脱,100分钟。
有时,脱酰胺肽较难从天然肽中分离或会在肽图中出现与其它肽的共洗脱峰。
如果分辨率不足,则可以增加pH。
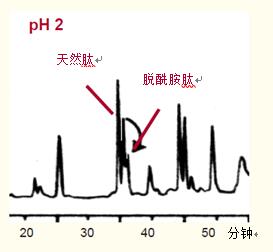
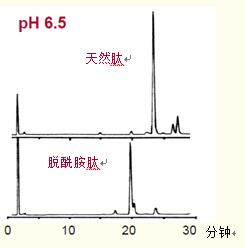
如图40所示,在低pH值下分离较差的脱酰胺肽能够在6.5的高PH值下从天然肽中有效分离。
在部分脱酰胺的人生长激素的低pH肽图中(图40A),脱酰胺肽出峰稍晚于天然肽,但与肽图中的另一种肽未分离。
对肽峰进行收集后以更高的pH(pH6.5)重新进行色谱分离。在高pH值下,脱酰胺肽中的天冬氨酸被电离,出峰早于含天冬酰胺的天然肽,且峰形好(图40B)。
图40. 部分脱酰胺的人生长激素的肽图中脱酰胺肽从天然肽的分离。
A pH=2时,部分脱酰胺的hGH的肽图(0.1% TFA)
B 收集含天然肽(顶部)和脱酰胺肽(底部)的肽图A中的肽段,在6.5的pH下重新进行色谱分析。
色谱柱:C4 宽孔柱, 4.6 x 250 毫米
|
A. 流动相:乙腈-0.1% TFA体系梯度洗脱,pH 2.0 |
B. 流动相:乙腈-30 mM 磷酸钠体系梯度洗脱,pH 6.5 |
 |
 |



