二硫键测定
蛋白质依靠正确的二硫键键合维持其三级结构和生物活性。
如果二硫键被还原或交换,则蛋白质会失去天然三级结构和生物活性。
HPLC保留值取决于蛋白质“疏水脚”的大小(图41),它会受到三级结构的影响。
二硫键的改变通常会使“疏水脚”增大,从而使蛋白质在反相HPLC中的保留值增大。
图42中,天然白细胞介素II的出峰远远早于被还原的白细胞介素II,这是由于当二硫键被还原时,蛋白质的三级结构发生了改变。
图41. 蛋白质保留值取决于“疏水脚”的大小。被还原的二硫键会使蛋白结构发生部分变性,这将增大“疏水脚”和反相保留值。
图42. 随着二硫键的还原,白细胞介素II的“疏水脚”会增大,从而增加蛋白质在反相HPLC上的保留值。
条件
色谱柱:C18 宽孔柱, 4.6 x 250 毫米
流动相:44.5%~50.8% 乙腈,以2 ml/min的流速进行90分钟的梯度洗脱
样品:白细胞介素II突变蛋白质
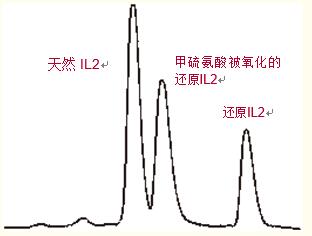
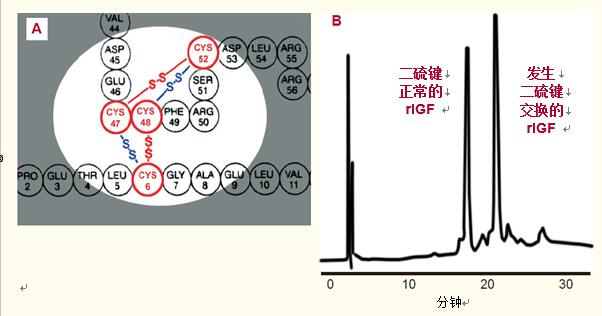
图43. 对二硫键合正常和发生二硫键交换的类胰岛素生长因子的分离。
条件
色谱柱:C4 宽孔柱, 4.6 x 250 毫米
流动相:20~38% 乙腈:异丙醇(88:12)—0.1% TFA体系,梯度洗脱,27分钟。
即使是细微的二硫键改变也足以对疏水脚产生影响,从而改变保留值。
天然类胰岛素生长因子(IGF)的Cys52和Cys47以及Cys48和Cys6之间都有二硫键(图43A红色部分所示)。
经过36小时的空气氧化,一些IGF蛋白分子内出现了二硫键交换,变成了Cys52和Cys48以及Cys47和Cys6间的二硫键键合(图43A蓝色部分)。
发生了二硫键交换的IGF比天然IGF出峰晚(图43),表明了疏水脚的增大。
天然蛋白的反相色谱法通常以反相保留值的变化揭示二硫键或蛋白三级结构的改变。
在蛋白酶水解蛋白过程中(通过省去DTT和羧甲基化过程),如果二硫键未被还原,则肽图中仍会包含二硫键合的二肽。
分别比较二硫键未还原和还原的肽图能够确定二硫键的位置。
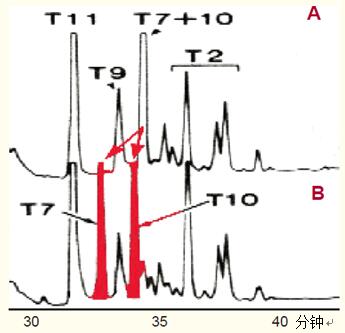
在二硫键还原和未还原条件下水解白细胞介素II,通过RP-HPLC法得到两种水解产物的肽图(图44)。
图44A中,以T7+T10标记出的肽是一种二硫键合的二肽。
在二硫键被还原的条件下得到的肽图显示了两种肽,分别为T7和T10(图44B)。
这证实了二硫键存在于这两种肽之间。
监测蛋白质水解产物肽能够确定各个二硫键在蛋白质中的位置。
如果一个胰蛋白酶肽段内存在两个半胱氨酸,则必须利用另一种蛋白酶确定参与到二硫键中的半胱氨酸。
通常将肽图分析和质谱法联用确定二硫键的位置和状态。
图44. 分别比较二硫键未还原(A图)和还原(B图)情况下白细胞介素II的肽图。
条件
色谱柱:C18 宽孔柱, 4.6 x 250 毫米
流动相:5~80% 乙腈—0.1% TFA体系,混合梯度洗脱,99分钟。
样品:
A二硫键未还原情况下白细胞介素II的肽图。
B二硫键还原情况下白细胞介素II的肽图。